SOAL OSK KIMIA TAHUN 2017
SOAL OSK KIMIA TAHUN 2017 - OSK Kimia 2017 merupakan post yang kita bagikan kali ini, semoga Soal Olimpiade Sains Nasional bidang kimia tahun 2017 tingkat Kabupaten / Kota jenjang SMA yang dibagikan admin bisa bermanfaat bagi sobat sekalian. Berikut adalah soal yang telah ditulis ulang oleh Team Juara Pendidikan :
Petunjuk Soal :
1. Isilah Biodata anda dengan lengkap di lembar yang
tersedia
2. Soal Teori ini terdiri dari dua bagian:
1. Tiga puluh (30) soal pilihan Ganda = 60 poin
2. Lima (5) soal essay = 80 poin
TOTAL
= 140 poin
3. Waktu yang disediakan: 150 menit.
4. Semua jawaban harus ditulis di lembar jawaban yang
tersedia.
5. Diperkenankan menggunakan kalkulator.
6. Diberikan Tabel Periodik Unsur.
7. Anda dapat mulai bekerja bila sudah ada tanda mulai
dari pengawas.
8. Anda harus segera berhenti bekerja bila ada tanda
berhenti dari Pengawas.
9. Letakkan jawaban anda di meja sebelah kanan dan
segera meninggalkan ruangan.
10. Anda dapat membawa pulang soal ujian.
A. Pilih jawaban yang paling tepat (30 soal @ 2 poin)
1. Di antara senyawa oksida
nitrogen berikut ini, yang mengandung 36,4% massa oksigen adalah...
A. NO
B. N2O
C. N2O3
D. N2O4
E. N2O5
2. Untuk mengoksidasi 25
gram cuplikan FeSO4 (Mr =
152), diperlukan 6,125 gram K2Cr2O7
(Mr = 294). Pada reaksi ini, ion dikromat berubah menjadi Cr3+
, sedangkan Fe2+ berubah menjadi Fe3+ .
Kadar FeSO4 dalam cuplikan di atas adalah....
A. 19%
B. 38%
C. 48%
D. 76%
E. 92%
3. Volume larutan H3PO4
0,1 M yang tepat bereaksi dengan larutan 50 mL Ba(OH)2 0,25 M adalah.....
A. 50 mL
B. 83,3 mL
C. 125 mL
D. 150 mL
E. 250 mL
4. Di antara konfigurasi elektron berikut yang menunjukkan unsur logam adalah..
A. 1s2 2s2 2p5
B. 1s2 2s2 2p6 3s2 3p6
C. 1s2 2s2 2p6 3s2 3p6 3d2 4s2
D. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1
E. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
5. Struktur
Lewis berikut ini:
adalah representasi
dari
A. NO2-
B. NO2+
C. NO2
D. NO2+ 1
dan NO2-
E. NO2, NO2+,
dan NO2-
6. Di antara senyawa
alkana berikut ini yang mempunyai interaksi
van der Waals paling tinggi adalah
A. CH3CH2CH2CH2CH2CH3
B. CH3CH2CH3
C. CH3CH2C(CH2)4CH3
D. CH3CH2CH2CH3
E. CH3 (CH2)3CH3
7. Jika NaBr larut dalam air, maka jenis gaya antarmolekul
yang harus diputuskan adalah
A. Gaya ion-ion
B. Ikatan-Hidrogen
C. Gaya ion-dipol
D. Gaya ion-ion dan ikatan-Hidrogen
E. Dipol-dipol
8. Di antara teknik teknik berikut ini yang tidak
dapat digunakan untuk menghitung ΔHreaksi
adalah...
A. Menggunakan panas
pembentukan reaktan dan produk
B. Menggunakan titik
leleh reaktan dan produk.
C. Hukum Hess
D. Menggunakan energi
ikatan reaktan dan produk
E. Kalorimetri
9. Di antara zat berikut ini
I. HCl(g)
II. Na(s)
III. HCl(aq)
IV. F2(g)
yang mempunyai
nilai entalpi pembentukan standard, ΔHof = 0 adalah
A. I, II, III, dan IV
B. I, II,dan IV
C. I dan II
D. II dan IV
E. Hanya II
10. Jika diketahui
data energi ikatan sebagai berikut: H-H = 436 kJ/mol, O-O = 142 kJ/mol, O=O = 499
kJ/mol dan H-O = 460 kJ/mol, maka entalpi reaksi pembentukan H2O2
adalah ...
A. –127
B. – 209
C. – 484
D. – 841
E. +127
11. Di antara padatan
berikut ini, yang memiliki interaksi antarmolekul hanya melalui gaya van der Waals
adalah
A. CO2
B. SiO2
C. Cu
D. MgO
E. CH3CH2OH
12. Jika tekanan
osmotik darah adalah 7,65 atm pada 37 ºC, maka massa (dalam gram) glukosa (C6H12O6,
massa molar = 180,2 g/mol) yang dibutuhkan untuk membuat 1,00 liter larutan injeksi
intravenous yang tekanan osmotiknya sama
dengan tekanan osmotik darah adalah
A. 3,00 g
B. 4,44 g
C. 25,4 g
D. 45,3 g
E. 56,0 g
13. Larutan aseton
dibuat dengan cara melarutkan 0,50 mol aseton (Po = 345 torr) dalam
1,00 mol etanol (Po
= 59,8 torr) pada 25 oC. Fraksi
mol aseton dalam fasa uap di atas larutan tersebut adalah
A. 0,26
B. 0,33
C. 0,50
D. 0,67
E. 0,74
14. Telah diketahui
bahwa sifat koligatif suatu larutan ditentukan oleh jumlah partikel zat terlarut. Anda melakukan percobaan untuk menentukan tekanan
uap jenuh dari keempat larutan berikut ini:
a. 0,13 m BaCl2
b. 0,22 m MnSO4
c. 0,24 m ZnSO4
d. 0,41 m Etilen
glikol (nonelektrolit)
Berdasarkan berkurangnya
tekanan uap larutan, maka urutan yang paling tepat adalah
A. a >
b > c > d
B. b > a > b > c
C. a >
d > c > b
D. a > d > b > c
E. d >
c > b > a
15. Untuk reaksi
fasa gas 3H2 + N2 → 2NH3, maka laju hilangnya H2
dibandingkan terhadap laju pembentukan NH3 adalah
A. Laju awalnya sama.
B. Laju hilangnya H2 adalah 1/2 laju munculnya
NH3.
C. Laju hilangnya H2 adalah 3/2 laju munculnya
NH3.
D. Laju hilangnya H2 adalah 2/3 laju munculnya
NH3.
E. Laju hilangnya H2 adalah 1/3 laju munculnya NH3.
16. Dalam suatu ruang
tertutup pada suhu tertentu terdapat 0,02 mol gas N2; 0,06 mol gas
H2 dan
0,05 mol gas NH3 dalam keadaan setimbang. Jika ke dalam ruang dimasukkan
0,1 mol Cr2O3
sebagai katalis, maka:
A. Jumlah mol N2 menjadi kurang dari
0,02
B. Jumlah mol NH3 menjadi 0,06 mol
C. Kesetimbangan bergeser ke kiri
D. Harga tetapan kesetimbangan K menjadi lebih besar
E. Susunan kesetimbangan tidak berubah
17. Pada temperatur tetap, perbandingan konsentrasi gas-gas SO2
: SO3
dalam
kesetimbangan reaksi
2SO2 (g) + O2 (g) ⇌ 2SO3 (g), akan berbanding lurus dengan
A. [O2] –2
B. [O ] –1/2
C. [O2]0
D. [O2]1/2
E. [O2]2
18. Jika anda mencampurkan
natrium hidroksida, NaOH, dan
asam asetat, CH3CO2H dalam jumlah molar
yang sama, maka spesi utama yang terdapat dalam larutan yang dihasilkan adalah (Diketahui:
Ka CH3CO2H = 2 x10-5)
A. Na+, CH3CO2-,
OH-, dan H2O
B. Na+, CH3CO2H,
OH-, dan H2O
C. Na+, CH3CO2-,
H3O+, dan H2O
D. Na+, CH3CO2H,
H3O+, dan H2O
E. Na+, CH3CO2-
, CH3CO2H, OH-,
dan H2O
19. Diketahui: Ksp
CdS = 3,6 x 10-29; Ksp ZnS = 1,1 x 10-21. Tetapan kesetimbangan reaksi berikut:
CdS(s) + Zn2+(aq) ⇌ ZnS(s) + Cd2+(aq)
adalah
A. 3,3 x 10-8
B. 2,7 x 10–4
C. 4,2 x 105
D. 2,5 x 1049
E. 3,1 x 107
20. Diketahui bahwa
H2S adalah asam yang lebih kuat daripada HCN. (H2S: Ka1 = 1,0 x 10-7;
Ka2 = 1,3 x 10-13; Ka HCN = 6,0 x 10-10).
Tentukanlah, bila
memungkinkan, ke arah manakah kesetimbangan berikut berada:
HCN(aq) + HS-(aq) ⇌ CN-(aq) + H2S(aq)
A. Kesetimbangan mengarah ke kiri
B. Kesetimbangan mengarah ke kanan
C. Kesetimbangan sempurna setimbang ke arah kiri dan
kanan
D. Dapat ditentukan bila keasaman relatif HS- diketahui
E. Tidak dapat ditentukan
21. Di antara asam
asam berikut ini yang mempunyai basa konjugasi paling kuat adalah
A. Asam Askorbat, Ka = 8,0 x 10-5
B. Asam Benzoat, Ka = 6,5 x 10-5
C. Asam 3-chlorobenzoat, Ka = 1,5 x 10-4
D. Asam 2-hidroksibenzoat, Ka = 1,1 x 10-3
E. Asam Chloroasetat, Ka = 1,4 x 10-3
22. Mengenai
setengah reaksi berikut ini:
Pernyataan yang
tepat adalah
A. Oksidasi
klor
B. Oksidasi H+
C. Reduksi
klor
D. Reduksi H+
E. Auto reduksi-oksidasi
23. Besarnya potensial
sel (Eo sel) untuk reaksi berikut ini:
A. +0,74 V
B. +1,48 V
C. +2,26 V
D. –1,48 V
E. – 2,26 V
24. Di antara kelompok
senyawa berikut yang termasuk aldehida, asam, dan alkohol
(tidak perlu berurutan)
adalah
A. HCO2H, CH3CO2CH3,
CH3CH2OH B. H2CO,
CH3CH2OH, CH3CO2CH3
C. CH3CO2H, CH3OH,
CH3CH2OCH3
D. H2CO, CH3CO2H,
CH3CHO
E. H2CO, CH3CO2H,
CH3CH2OH
25. Di antara kelima
senyawa organik di bawah ini yang paling benar tatanamanya secara
IUPAC adalah
A. 2-bromo-4-hidroksi-4-pentena
B. 2-metil-1-pentena-4-ol
C. 2-kloro-1,3-sikloheksadiena
D. 2-metil-2-heksena-4-ol
26. Urutan keasaman yang paling tepat untuk senyawa-senyawa
berikut
adalah
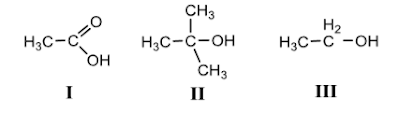
A. I > III
> II
B. I > II > III
C. II > I > III
D. II > III > I
E. III >
I > II
27. Semua senyawa
berikut ini mempunyai rumus molekul C4H10O dan merupakan isomer.
Yang bukan isomer
C4H10O adalah
A. Butanon
B. Dietil eter
C. Metil propil eter
D. 1-butanol
E. 2-metil-2-propanol
Reaksi tersebut
adalah:
A. Reaksi
substitusi
B. Reaksi
adisi Markovnikov
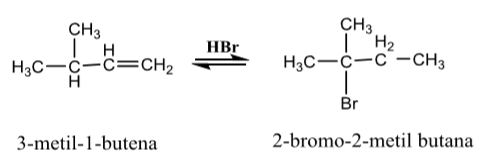
D. Reaksi
eliminasi
29. Jika senyawa
sikloheksena direaksikan dengan (Br2, hʋ) sebagaimana skema berikut:
maka bromida dapat
masuk pada posisi nomor
A. Pada nomor 1 dan 6
B. Pada nomor 2 dan 3
C. Pada nomor 2 atau 5
D. Pada nomor 3 dan 4
E. Hanya 4
30. Di antara
spesi berikut yang merupakan ion karbonium tersier adalah
Nah itulah 30 soal choise OSK kimia tahun 2017, untuk soal essai silakan klik disini








Post a Comment for "SOAL OSK KIMIA TAHUN 2017"